【CBM】钱文斌/张会来教授等总结提高CAR-T淋巴瘤疗效的策略
2025-04-23 聊聊血液 聊聊血液
本文综述了近年来为提高CAR-T细胞疗法在淋巴瘤治疗中的疗效所采取的多项策略,包括改进抗原识别、抑制免疫检查点信号、增强杀伤能力、提高安全性以及代谢和表观遗传调控等方面的创新方法。
增强CAR-T
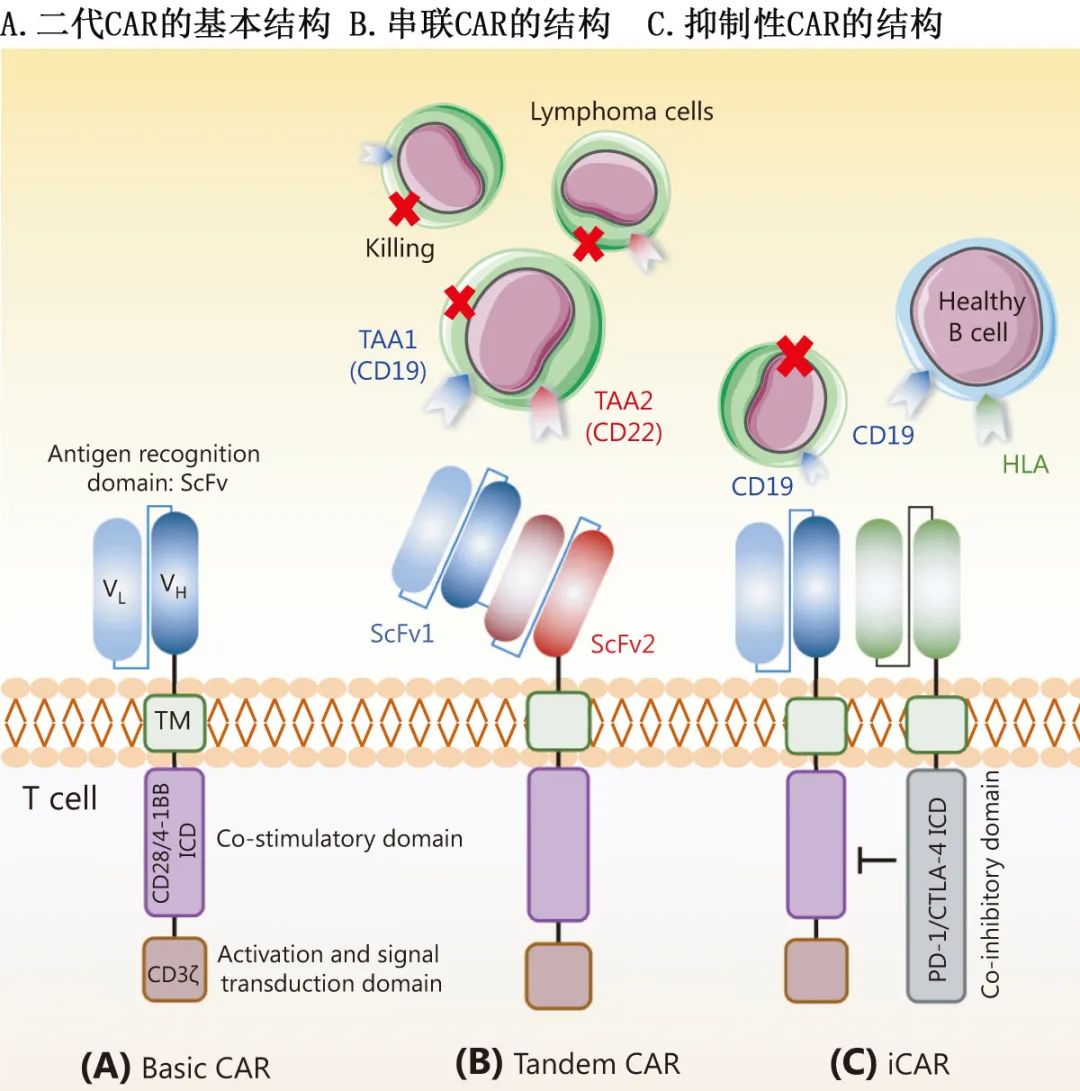
CAR-T细胞通过基因编程,能够特异性识别并杀死靶细胞,基本结构包括:抗原识别的单链可变片段(scFv)、铰链区、跨膜域、共刺激域和信号传导域。CAR-T细胞疗法在治疗化疗耐药的B细胞淋巴瘤(BCL)方面取得了显著进展,但长期疗效仍面临肿瘤细胞异质性、免疫抑制微环境、CAR-T细胞耗竭和不可控不良事件等挑战。
钱文斌教授和张会来教授等近日于《Cancer Biology & Medicine》发表文章,综述了近年来为提高CAR-T细胞疗法在淋巴瘤治疗中的疗效所采取的多项策略,包括改进抗原识别、抑制免疫检查点信号、增强杀伤能力、提高安全性以及代谢和表观遗传调控等方面的创新方法。

提高抗原识别能力
OR逻辑门:通过双特异性CAR-T细胞(如CD19/CD20或CD19/CD22串联CAR)防止肿瘤抗原逃逸,提高对异质性肿瘤细胞的杀伤效果。
AND-NOT逻辑门:通过抑制性CAR(iCAR)识别健康细胞特异性抗原(如HLA),减少“脱靶毒性”,保护正常组织。
阻断免疫检查点信号以克服肿瘤微环境(TME)
阻断抑制性受体-配体相互作用:例如,通过沉默PD-1或CTLA-4基因,增强CAR-T细胞的抗肿瘤活性。
转换抑制信号为共刺激信号:设计“开关受体”(如PD-1/CD28),将抑制信号转化为激活信号,增强CAR-T细胞的持久性和杀伤能力。

通过细胞因子增强杀伤能力
IL-12和IL-15:通过NFAT响应元件或IL-15/IL-15Rα复合物增强CAR-T细胞的增殖和抗肿瘤活性。
IL-7和趋化因子:如IL-7与CCL19联合表达,促进CAR-T细胞迁移和浸润至肿瘤部位,同时减少耗竭标志物的表达。

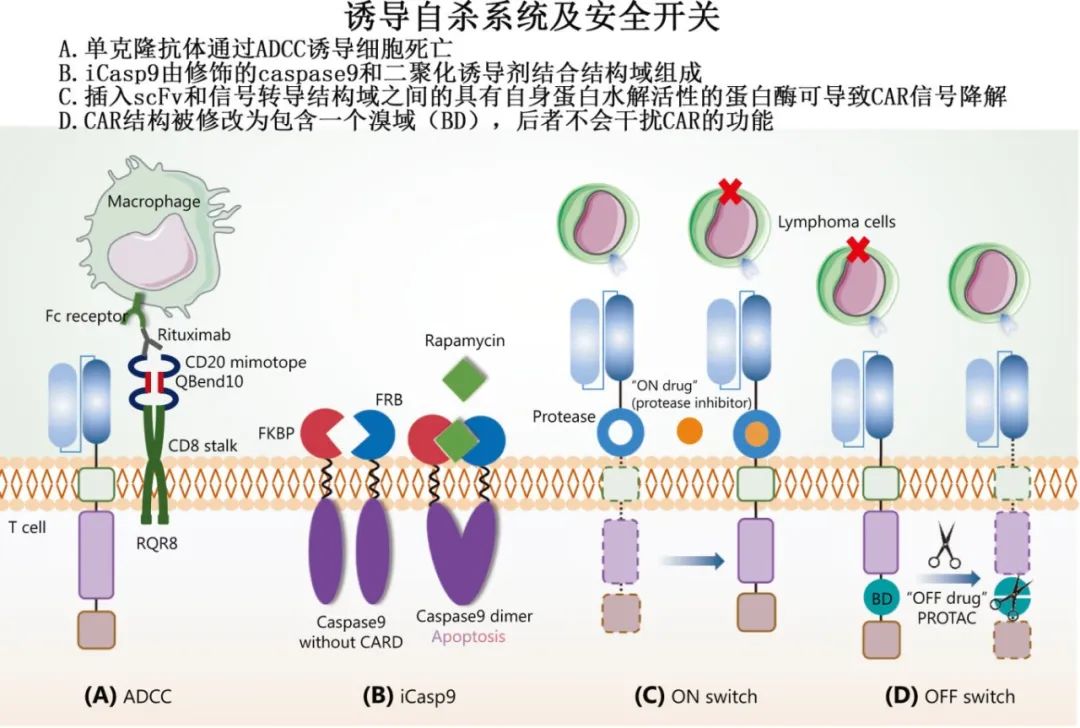
通过安全开关降低不良反应
自杀系统:如诱导型半胱天冬酶9(iCasp9)或EGFRt标记,通过药物(如雷帕霉素或西妥昔单抗)快速清除CAR-T细胞,控制毒性。
ON-OFF开关:如蛋白酶依赖的CAR信号调控(HCV-NS3/ASV系统),实现CAR-T细胞功能的可逆控制。
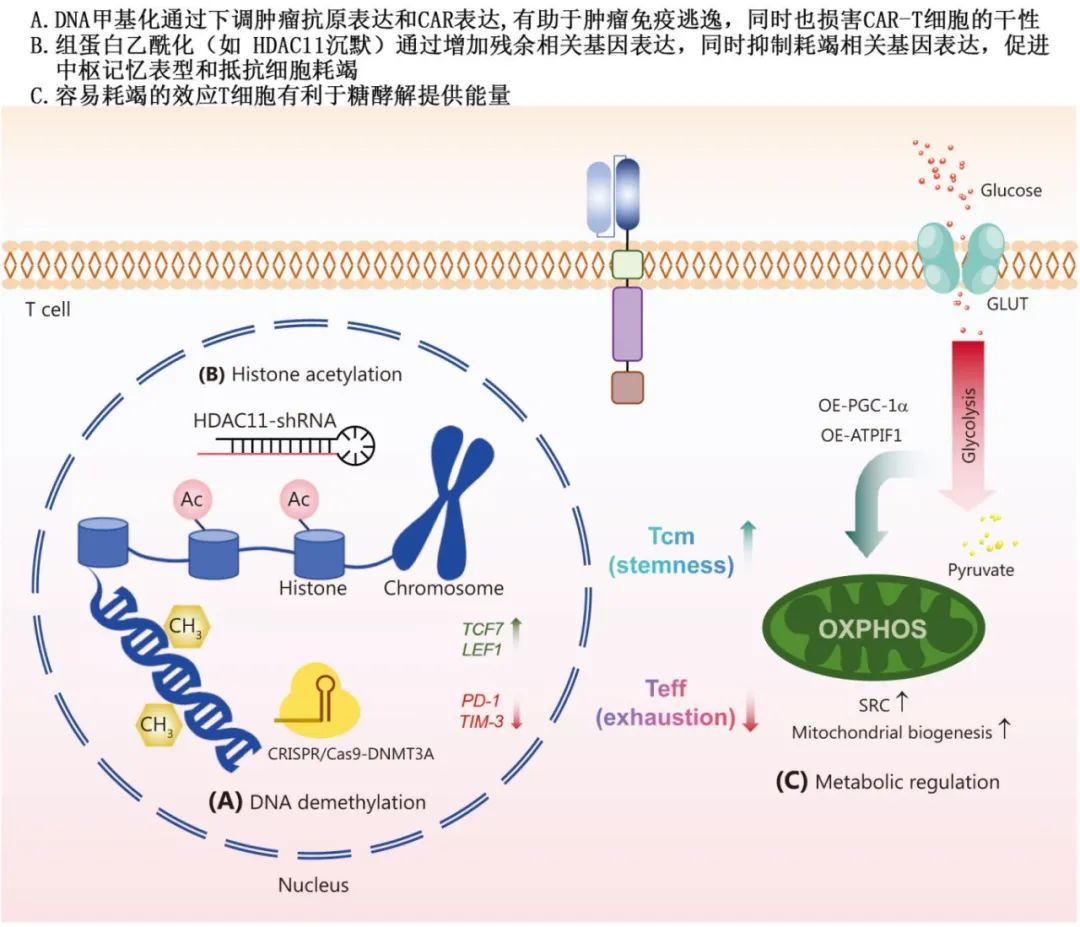
表观遗传调控和代谢调控
DNA去甲基化:使用地西他滨等抑制剂减少CAR-T细胞的耗竭,增强记忆表型。
组蛋白乙酰化:抑制HDAC11等去乙酰化酶,维持CAR-T细胞的干性和抗肿瘤功能。
靶向糖代谢:通过过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)等促进氧化磷酸化(OXPHOS),减少糖酵解依赖,增强CAR-T细胞的持久性。
靶向氨基酸和脂肪酸代谢:如抑制ACAT1增强免疫突触形成,或通过分支链氨基酸促进CAR-T细胞增殖。
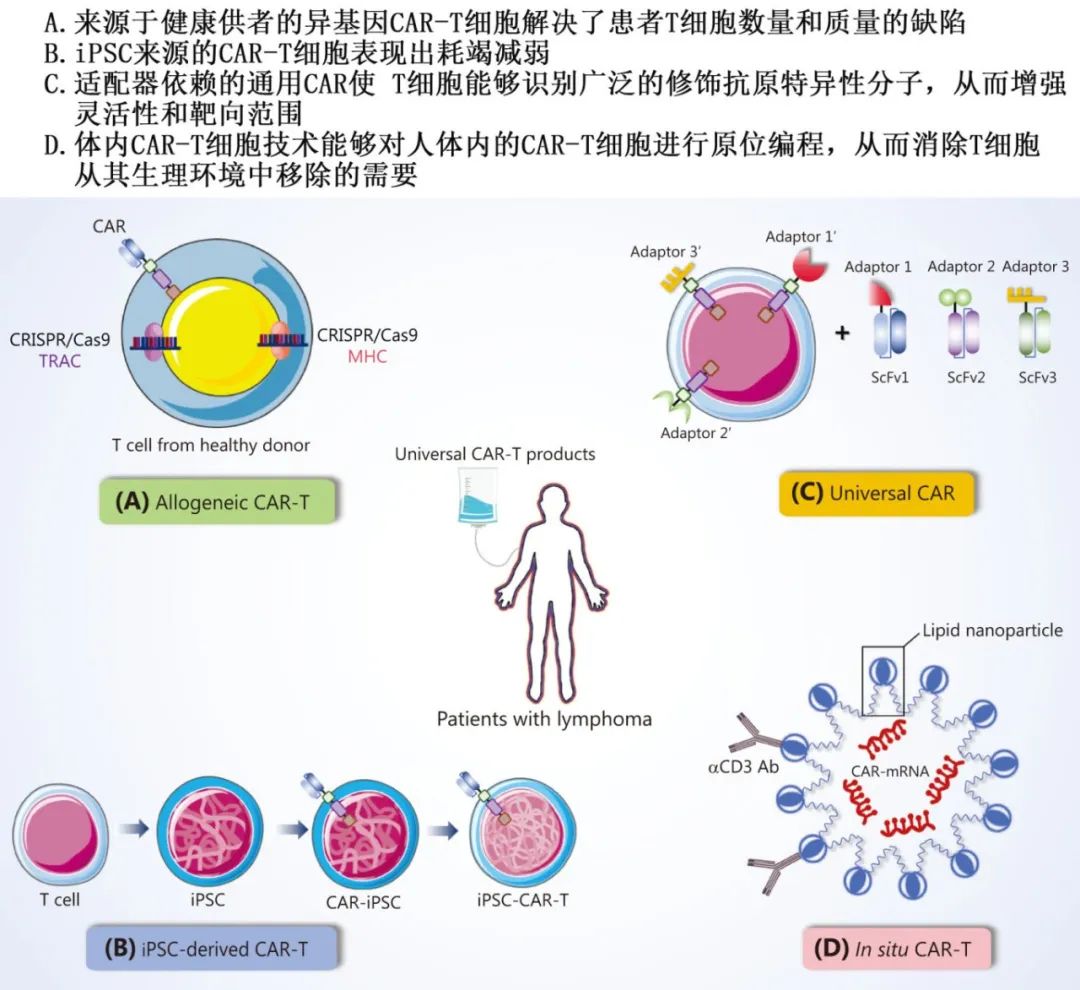
通用型CAR-T细胞疗法
基因编辑异基因T细胞:通过CRISPR/Cas9敲除TCR和MHC基因,减少移植物抗宿主病(GVHD),实现“现货型”CAR-T产品。
iPSC来源的CAR-T细胞:利用诱导多能干细胞(iPSC)无限扩增的特性,生产均一且功能增强的CAR-T细胞。
适配器依赖(Adaptor-dependent)的通用CAR:通过“锁-钥”模块设计,灵活切换靶抗原,提高治疗适应性。
原位CAR-T细胞:通过脂质纳米颗粒(LNP)递送CAR基因,在体内直接编程T细胞,简化治疗流程。
总体而言,CAR-T细胞疗法在淋巴瘤治疗中具有较大潜力,但当前也面临挑战。通过多种策略的综合应用,可以显著提高CAR-T细胞治疗的疗效和安全性,为复发/难治性淋巴瘤患者提供新的治疗选择。
参考文献
Cancer Biol Med . 2025 Apr 15:j.issn.2095-3941.2024.0538. doi: 10.20892/j.issn.2095-3941.2024.0538.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#淋巴瘤# #Car-T细胞疗法#
6